江苏省镇江市2015年高三上学期期末考试化学试题及答案(4)
学习频道 来源: 阳光学习网 2025-02-26 大 中 小
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ▲ 。
17.(14分)下图所示为某一药物F的合成路线:
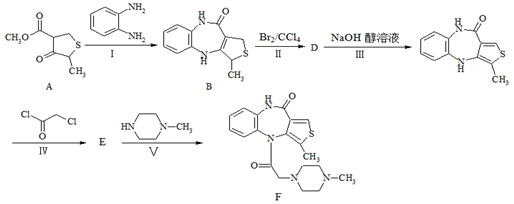
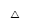
(1)A中含氧官能团的名称分别是 ▲ 、 ▲ 。
(2)步骤Ⅱ发生反应的类型是 ▲ 。
(3)写出步骤Ⅲ的化学反应方程式 ▲ 。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式: ▲ 。
①不含甲基;
②是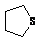 的衍生物,且环上只有一个取代基;
的衍生物,且环上只有一个取代基;
③能发生银镜反应和水解反应(不考虑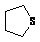 的变化)。
的变化)。
(5)请参照上面合成路线,以间二甲苯、ClCH2COCl、(C2H5)2NH为有机原料(无机试剂任选)合成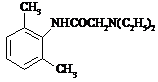 。
。
提示:①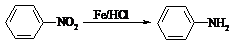 ;
;
② 合成路线流程图示例: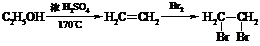 。
。
▲ 。
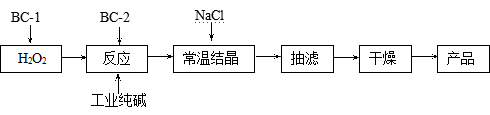 18.(12分)过碳酸钠(2Na2CO3·3H2O2 )俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下:
18.(12分)过碳酸钠(2Na2CO3·3H2O2 )俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下:
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 ▲ 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 ▲ 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 ▲ (填写序号)。
A.饱和氯化钠溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过
碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol·L-1Na2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
19.(16分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
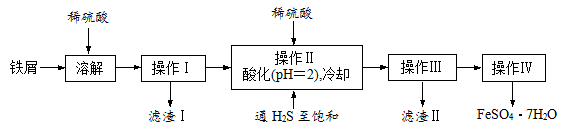
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ▲ ;
操作II,在溶液中用硫酸酸化至pH=2的目的是 ▲ 。
(2)操作IV的顺序依次为: ▲ 、 ▲ 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② ▲ 。
(4)测定绿矾产品中Fe2+含量的方法是:
a. 称取一定质量绿矾产品,配制成250.00mL溶液;
b. 量取25.00mL待测溶液于锥形瓶中;
c. 用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体
积的平均值为20.00mL。滴定时发生反应的离子方程式为:
5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定时,左手把握酸式滴定管的
活塞,右手摇动锥形瓶,眼睛注视 ▲ 。
②判断此滴定实验达到终点的方法是 ▲ 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生
的误差可忽略),其可能原因有 ▲ 。
化学学习经验 http://www.yggk.net/huaxue/